Les trois étapes du cycle de l’addiction et leurs mécanismes cérébraux
L’addiction se développe uniquement chez un sous-ensemble d’individus (environ 15 %) suite à des expositions répétées à la drogue (Nielsen et al., 2014) et suit généralement un cycle divisé en trois étapes se succédant au fil du temps. Ces étapes sont la phase de binge/intoxication, la phase de sevrage/affects négatifs, et la phase de préoccupation/anticipation (Anthony et Petronis, 1995). La « phase de Binge/Intoxication » est caractérisée par la recherche initiale et la consommation excessive d’une substance pour son effet gratifiant de manière récréative. Pendant cette phase, l’individu développe les habitudes de consommation de la drogue (section 2.1). Par la suite, les individus tombent dans la « phase de Sevrage/Affects Négatifs » marquée par l’émergence de malaise et d’émotions négatives lors du sevrage de la drogue (section 2.2). Cet état négatif pousse les individus vers la « phase de Préoccupation/Anticipation » où ils deviennent préoccupés par l’obtention et l’utilisation de la substance comme moyen d’atténuer le malaise du sevrage, perpétuant ainsi le cycle de l’addiction (section 2.3). Ces cycles sont associés à trois mécanismes neurobiologiques majeurs liés à différentes modifications des fonctions cérébrales qui sont le traitement anormal de la récompense (saillance de l’incitation), l’augmentation des émotions négatives et la fonction cognitive altérée (fonction exécutive inférieure) (Bickel et al., 2018 ; Koob et Volkow, 2016).
1. Phase 1 – Phase de Binge/Intoxication
La phase de Binge/Intoxication se caractérise par la consommation sporadique et récréative initiale d’une substance ou la participation à un comportement pour obtenir un effet gratifiant. Pendant cette phase, les individus commencent lentement à rechercher et à consommer la substance de manière automatique, ce qui devient finalement habituel.
Cette phase est pilotée par les ganglions de la base et le système de récompense. Le système de récompense englobe plusieurs structures cérébrales, notamment la zone tegmentale ventrale (VTA) dans le mésencéphale et le noyau accumbens (NAc) situé dans le striatum ventral. Le rôle de la VTA est de libérer de la dopamine dans le NAc, induisant ainsi des sensations de satisfaction et de motivation pour un comportement spécifique. Alors que la fonction biophysique du système de récompense est de stimuler la motivation pour des comportements biologiques fondamentaux tels que la survie, les interactions sociales et la reproduction, toutes les substances d’abus induisent la libération de dopamine, générant ainsi une sensation artificielle de récompense, contribuant ainsi au développement de l’addiction (Koob et Volkow, 2016). Avec la prise répétée du médicament, les propriétés gratifiantes des substances sont réduites et l’individu doit consommer de plus en plus pour continuer à ressentir la même sensation de satisfaction. De plus, les comportements de recherche et de prise deviennent habituels et impulsifs, et ne sont plus dirigés par des objectifs et des valeurs (recherche de plaisir). Les comportements impulsifs et habituels (autonomes, indépendamment du résultat), par opposition aux comportements dirigés par des objectifs et des valeurs, persisteront même lorsque le résultat du comportement n’est plus désiré ou souhaité.
Les comportements impulsifs proviennent du conditionnement de stimuli neutres précédents. Ce conditionnement se produit en raison d’une augmentation rapide et prononcée des niveaux de dopamine dans le striatum ventral qui active le récepteur D1, donnant une sensation de récompense élevée, induisant ainsi une réponse conditionnée associée aux propriétés gratifiantes de la consommation de la substance. Ces stimuli neutres conditionnés (cue/contexte/prédicteur) et les états physiologiques induisent une libération importante de dopamine dans le NAc, entraînant une envie de la substance, une forte motivation à rechercher la substance et un comportement compulsif (saillance de l’incitation) (Volkow et al., 2010).
Le comportement habituel provient d’un changement d’activité du striatum ventral et dorsomédial (impliqué dans les comportements dirigés par des objectifs et des valeurs) vers le striatum dorsal et dorsolatéral (comportement habituel, automatique et basé sur les stimuli) (Lipton et al., 2019 ; Sjoerds et al., 2013). Ce changement peut expliquer le développement du comportement compulsif dans l’addiction car l’individu devient incapable de revenir à un comportement dirigé par des objectifs (Everitt et Robbins, 2013 ; Zapata et al., 2010). De plus, il a été démontré que l’activité accrue du striatum dorsolatéral augmentait le comportement de recherche de médicaments résistant à la punition chez les rats, ce qui pourrait expliquer la persistance de la recherche d’alcool malgré la punition (Pelloux et al., 2012). Le striatum dorsolatéral est également impliqué dans l’exécution de séquences d’actions car ses neurones se déclenchent au début et à la fin d’une routine comportementale. Cet encadrement de la tâche est en partie la raison pour laquelle les individus, lorsqu’ils voient des stimuli conditionnés ou sont dans un certain état émotionnel, commencent à rechercher et à consommer la substance abusive. Parfois, ils le font sans même s’en rendre compte, car le striatum dorsolatéral veut terminer tout
2. Phase 2 – Sevrage avec ses affects négatifs
La phase de sevrage est marquée par l’émergence de malaise et d’émotions négatives lors du sevrage de la substance addictive ou du comportement addictif. Pendant cette phase, l’individu ressent l’opposé de ce qu’il ressent lorsqu’il consomme la drogue. Cela peut inclure une large gamme d’états émotionnels négatifs, notamment une irritabilité chronique, une douleur émotionnelle, un malaise, une dysphorie, une alexithymie, du stress, une perte de motivation et de stimulation pour les récompenses naturelles, de l’anxiété, une réduction de la locomotion. Cet état émotionnel négatif provient d’une activité réduite des systèmes de récompense et anti-stress, et d’une activité accrue des systèmes de stress, qui sont pilotés par l’amygdale.
Une exposition chronique à la substance abusive entraîne une hypofonctionnement de la voie dopaminergique contribuant au manque de motivation pour les récompenses naturelles et aux symptômes émotionnels négatifs associés à la craving et à la rechute. Les individus souffrant de troubles liés à la consommation de substances présentent une régulation à la baisse des récepteurs de la dopamine D2 (D2R) dans le striatum ventral qui persiste pendant des mois après la désintoxication. Cette régulation à la baisse de D2R est associée à une diminution du métabolisme basal du glucose dans le cortex préfrontal (PFC), à l’impulsivité chez les consommateurs de méthamphétamine, à une grande craving induite par des stimuli pour l’alcool et à une administration compulsive de cocaïne chez les rongeurs (Heinz et al., 2005, 2004; Swift and Aston, 2015). Pendant cette phase, de nombreux autres systèmes neurotransmetteurs, notamment les opioïdes, la sérotonine, le GABA, le glutamate, les endocannabinoïdes, sont également modifiés, contribuant ainsi à l’altération du système de récompense (Koob and Volkow, 2016).
Pendant ce temps, le système de stress devient hyperactif. Plus spécifiquement, les patients souffrant de troubles liés à la consommation de substances présentent une hyperactivité de l’habénula, impliquée entre autres dans le traitement des récompenses et des aversions, dans l’amygdale, impliquée dans le renforcement négatif, la peur et contribuant à la recherche compulsive de drogues et à la dépendance, et dans l’axe hypothalamo-hypophysaire-surrénalien, impliqué dans le stress (Batalla et al., 2017). Cela est notamment dû à des niveaux élevés d’hormones et de neurotransmetteurs de stress, y compris l’hormone corticotrope, le cortisol, le facteur de libération de la corticotropine (CRF) et la dynorphine (neuropeptide impliqué dans la douleur, l’addiction et la régulation de l’humeur) dans le cerveau (Delfs et al., 2000; Koob et al., 2014; Koob and Volkow, 2016). De plus, alors que les neurones dopaminergiques deviennent moins actifs, le facteur de libération de la corticotropine (CRF), la noradrénaline et la dynorphine sont recrutés dans l’amygdale élargie et induisent des états émotionnels négatifs (Koob and Volkow, 2016). Cela est étayé par une étude observant que les antagonistes du CRF bloquaient l’anxiété, le stress du sevrage de drogue et la consommation excessive de drogue lors de la recherche compulsive de drogue chez les animaux. Ce système de stress hyperactif va exacerber la formation d’habitudes et l’inflexibilité comportementale en augmentant la connectivité de l’amygdale au striatum (Giovanniello et al., 2023). De plus, le contrôle inhibiteur du PFC sur le mésencéphale et le striatum ventral devient moins efficace, laissant ainsi l’amygdale prendre le contrôle du comportement habituel (Goldstein and Volkow, 2011).
En plus de l’activation des systèmes de stress, les systèmes anti-stress sont régulés à la baisse. Les neurotransmetteurs clés agissant en opposition aux systèmes cérébraux de stress, notamment le neuropeptide Y, la nociception, les endocannabinoïdes, la substance P, les récepteurs de peptide opioïde et l’ocytocine, sont régulés à la baisse (Koob, 2008). Cela contribue grandement à l’augmentation de la réactivité au stress dans l’addiction. Ce développement d’états émotionnels aversifs, médié par un système de stress hyperactif et des systèmes anti-stress hypoactifs, pourrait contribuer à la rechute chronique observée dans la toxicomanie où les individus atteints de dépendance retournent constamment à la recherche compulsive et à la prise de drogue après le sevrage. Pour réduire ces états émotionnels aversifs, les individus en phase de sevrage recherchent et consomment la drogue, malgré les conséquences néfastes et indépendamment du temps passé et de la perte de but et de comportement basé sur la valeur. Ces affects négatifs finissent par conduire au développement de la troisième phase de l’addiction, la phase de préoccupation/anticipation.
Pour résumer, dans la phase de sevrage, des états émotionnels négatifs émergent en raison d’altérations des systèmes de stress et de récompense, y compris l’amygdale et l’habénula, incitant les individus à rechercher un soulagement par la consommation de substances malgré les conséquences négatives, préparant le terrain pour une progression ultérieure de l’addiction.
3. Phase 3 – Phase de préoccupation/anticipation
La phase de préoccupation/anticipation est la phase où les individus ressentent un besoin irrépressible et perdent progressivement le contrôle de leur comportement. Cela se traduit par une recherche pathologique de drogue malgré les conséquences néfastes possibles pour soi-même et pour les autres, la compulsivité et la rechute comme moyen de soulager le malaise du sevrage (Koob, 2013 ; Yue Li et al., 2021 ; Piazza et Deroche-Gamonet, 2013). Cette perte de contrôle provient du développement de comportements stimuli-dépendants et habituels (transition du striatum ventral au striatum dorsal) et de niveaux de stress accrus (hyperactivation de l’amygdale et émotions négatives accrues). Cette phase est principalement pilotée par des dysfonctionnements du PFC, notamment le PFC médian et le cortex orbitofrontal (OFC), qui sont associés à une aggravation des résultats, à une augmentation de la consommation de drogues, à une altération des tâches liées au PFC et à une plus grande probabilité de rechute (Goldstein et Volkow, 2011).
À mesure que l’addiction se développe et que l’utilisation de drogue devient habituelle, l’activité du PFC médian est réduite jusqu’à devenir hypofonctionnelle. Le PFC médian est impliqué dans le contrôle descendant, les fonctions métacognitives, la régulation des émotions (y compris le conditionnement et l’attribution de la valeur incitative aux indices liés à la drogue et à la drogue), la prise de décisions morales, l’autorégulation, le contrôle inhibiteur et la mémoire de travail. Son dysfonctionnement réduira ses connexions avec le système dopaminergique mésolimbique, permettant ainsi au striatum dorsal (comportement dirigé par les habitudes) de prendre le contrôle. Cela peut favoriser l’apparition de comportements de recherche et compulsifs. Ce dysfonctionnement du PFC médian peut être dû à une perte de neurones glutamatergiques du PFC médian projetant vers le VTA et le Nac, à une activité GABA perturbée et à un rôle altéré des récepteurs D1R et D2R dans le striatum (Chudasama et Robbins, 2006 ; Geisler et Wise, 2008 ; Jentsch et Taylor, 1999).
Pendant cette étape, l’activité de l’OFC est également altérée. L’OFC est impliqué dans la promotion du comportement dirigé par les objectifs en calculant la valeur coût-bénéfice des actions pour contrôler le comportement en fonction de la représentation active de la valeur du résultat attendu (Padoa-Schioppa et Assad, 2006). Pour accomplir cette fonction, l’OFC intègre les informations de l’insula, une région cérébrale impliquée dans la fonction interoceptive pour intégrer les informations autonomes et viscérales avec l’émotion et la motivation, et de l’amygdale (Craig, 2002) et envoie les informations au striatum ventral et dorsal pour induire des changements dynamiques dans les systèmes de récompense (Lipton et al., 2019). Une activité accrue de l’OFC a été démontrée pour induire un comportement dirigé par les objectifs, tandis qu’une réduction de son activité a induit un comportement davantage dirigé par les habitudes et compulsif (consommation accrue d’alcool insensible à la quinine) chez les souris, probablement parce que l’OFC n’inhibera plus le striatum dorsolatéral (Renteria et al., 2018). La même étude préclinique a observé que la réactivation de l’OFC était suffisante pour restaurer le comportement et réduire le contrôle habituel, suggérant ainsi que le contrôle réduit de l’OFC dans l’addiction intensifie les comportements de type habituel. De plus, une étude clinique d’imagerie a observé une réduction du métabolisme basal du glucose de l’OFC pendant la dépendance (Volkow et al., 1999). En revanche, d’autres études ont observé que l’hyperfonctionnement de l’OFC pourrait non seulement favoriser l’apparition de la compulsivité (Milella et al., 2016 ; Volkow et al., 1999), mais pourrait également être impliqué dans l’induction de signaux associés à la drogue, la recherche de cocaïne et la recherche de rétablissement induit par le stress (Kober et al., 2016 ; Lee et al., 2005 ; Risinger et al., 2005 ; Schoenbaum et Shaham, 2008). De plus, une étude préclinique a trouvé une activité accrue de l’OFC chez les souris addictes (Pascoli et al., 2018) et a rapporté que l’inhibition de l’OFC pourrait réduire l’autostimulation compulsive (Pascoli et al., 2015). Davantage de recherches sont nécessaires pour clarifier le rôle de l’OFC dans la promotion et/ou l’inhibition du comportement habituel automatique.
En résumé, la phase de Préoccupation/Anticipation est caractérisée par la craving et la perte de contrôle du comportement, induites par des dysfonctionnements du PFC et des niveaux de stress accrus impliquant l’amygdale, entraînant une recherche pathologique de drogue et une probabilité accrue de rechute.
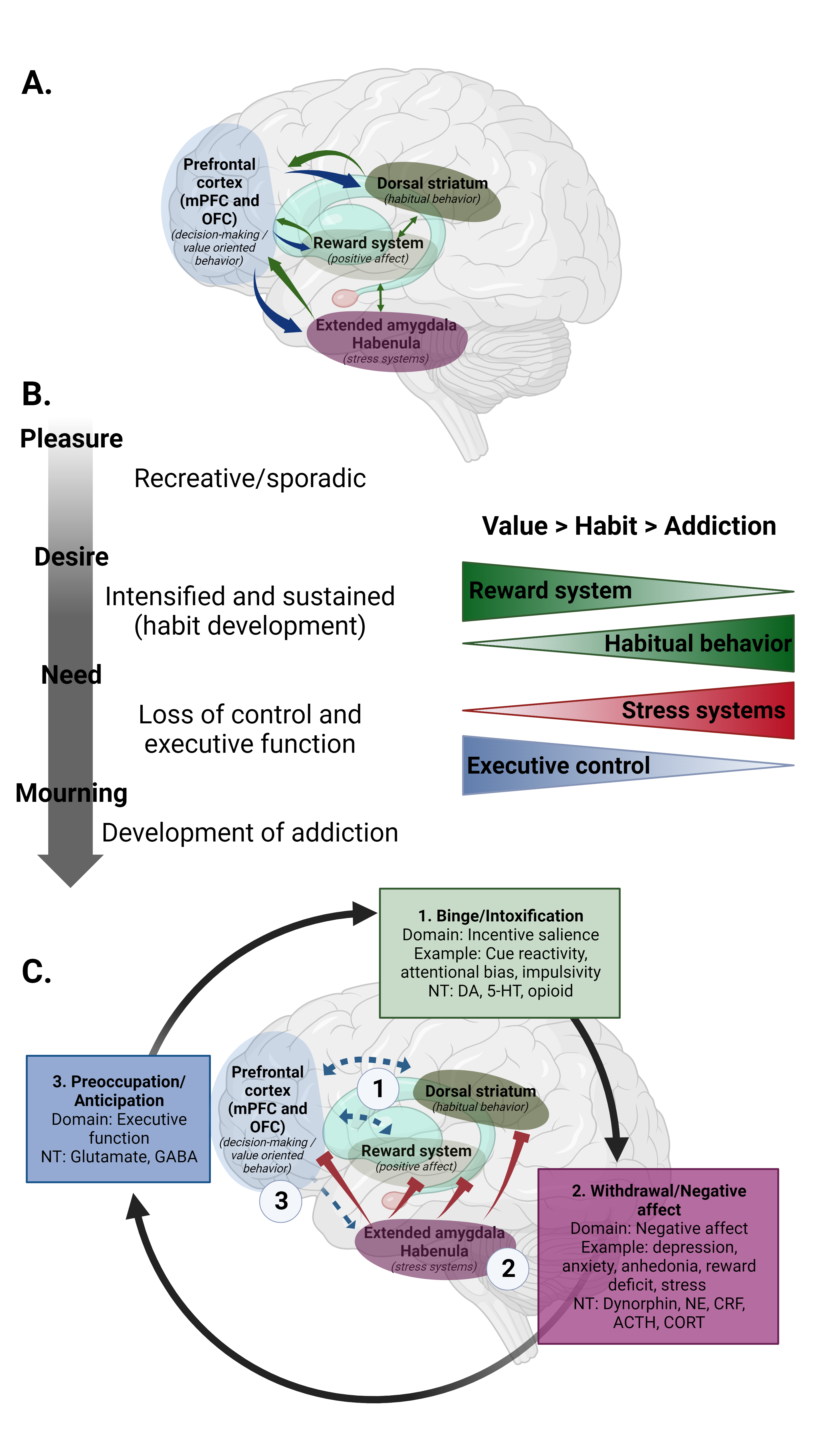
Figure 1. Transition vers la chronicité dans l’addiction. A. Cerveau sain. L’individu possède un système de récompense fonctionnant normalement, le striatum dorsal n’est pas encore actif car l’utilisation de la drogue n’est pas encore devenue habituelle, l’amygdale a une activité de base normale et le cortex préfrontal joue son rôle de médiateur des structures limbiques. B. Le développement de l’addiction. L’usage de la drogue passe du plaisir au besoin, par le désir et le besoin. Les individus passent de la prise de drogue par plaisir à la perte de contrôle et au développement de l’addiction. Cela se manifeste (panneau de droite) par la réduction de l’activité du système de récompense, l’augmentation du comportement habituel, l’augmentation des systèmes de stress et la réduction du contrôle exécutif. C. Cerveau sous addiction. La neurocircuiterie globale comprend les trois domaines fonctionnels : 1. Consommation excessive/Intoxication : médiée par la dopamine, la sérotonine et les opioïdes. Cette étape implique le développement de l’utilisation habituelle de la drogue, entraînant ainsi une réduction de l’activité du système de récompense et une augmentation du fonctionnement du striatum dorsal. 2. Sevrage/Affects négatifs : médiée par la dynorphine, la norépinéphrine (NE) et le facteur de libération de la corticotropine (CRF). Cette étape implique l’hyperactivité de l’axe du stress et une réduction des systèmes anti-stress.
3. Préoccupation/Anticipation : médiée par le glutamate et le GABA. Cette étape implique une hypoconnectivité entre le cortex préfrontal et le système limbique. Les flèches représentent les connexions entre les régions du cerveau. Les flèches rouges sont inhibitrices. Les flèches bleues et vertes complètes représentent la connectivité mutuelle. La flèche bleue pointillée représente une connectivité et un contrôle réduits. ACTH = hormone adrénocorticotrope, NT = neurotransmission, NE = norépinéphrine, CRF = facteur de libération de la corticotropine, CORT = corticostérone, DA = dopamine, 5-HT = sérotonine. GABA = acide gamma-aminobutyrique. Adapté de Uhl et al. 2019 et Cheron et al. 2021 (Cheron et Kerchove d’Exaerde, 2021; Koob et Volkow, 2016).
4. Résumé
En résumé, l’addiction progresse à travers trois étapes distinctes, chacune caractérisée par des mécanismes neurobiologiques spécifiques. La phase de **consommation excessive/intoxication** initie le cycle, sous l’influence des ganglions de la base et du système de récompense, faisant passer les individus d’un comportement dirigé par des objectifs à un comportement habituel. La phase de **sevrage/affects négatifs** suit, marquée par une diminution de l’activité du système de récompense et une augmentation de l’activité des systèmes de stress, déclenchant des états émotionnels négatifs et incitant les individus à rechercher un soulagement par l’utilisation de substances. Enfin, la phase de **préoccupation/anticipation** se produit, causée par des dysfonctionnements dans le cortex préfrontal et des niveaux de stress élevés, résultant en des envies, une perte de contrôle du comportement et une recherche pathologique de drogue.
Cependant, il est important de noter que tous les patients ne progressent pas de la même manière à travers ces étapes en raison de l’hétérogénéité clinique influencée par des facteurs génétiques et environnementaux (Destoop et al., 2019; Heilig et al., 2021a, 2021b; Luderer et al., 2021), ce qui peut affecter l’efficacité du traitement (Heilig et al., 2011). Par exemple, à des stades avancés de l’addiction, certains patients éprouvent encore du plaisir en consommant la drogue (Bogg et al., 2016; Comeau et al., 2001; Littlefield et al., 2010). Comprendre ces étapes et les différences individuelles est donc crucial pour développer des stratégies de traitement personnalisées adaptées aux besoins uniques de chaque patient, optimisant ainsi les résultats dans le traitement de l’addiction.
Conclusion
Le cycle de l’addiction comprend trois phases principales : la consommation excessive/intoxication, le sevrage/affects négatifs et la préoccupation/anticipation. Chaque phase est caractérisée par des mécanismes cérébraux distincts qui contribuent à la perpétuation du comportement addictif.
1. Phase de consommation excessive/intoxication : Les comportements de recherche et de prise de drogue deviennent automatiques et habituels, motivés par le système de récompense (VTA et NAc) et se déplacent vers le striatum dorsal et dorsolatéral, réduisant ainsi le contrôle dirigé par des objectifs.
2. Phase de sevrage/affects négatifs : L’hypofonction du système de récompense et l’hyperactivité des systèmes de stress (principalement l’amygdale et l’axe hypothalamo-hypophyso-surrénalien) conduisent à des états émotionnels négatifs, augmentant la motivation à consommer la drogue pour soulager l’inconfort.
3. Phase de préoccupation/anticipation : La dysfonction du cortex préfrontal et l’activité dopaminergique dans le striatum ventral entraînent une forte envie de consommer la substance, avec une difficulté accrue à contrôler les impulsions et à résister aux envies.
Ensemble, ces mécanismes cérébraux expliquent pourquoi l’addiction est un cycle persistant et difficile à briser, nécessitant une approche multifacette pour le traitement et la réhabilitation.
Je t’invite à me suivre pour recevoir d’autres articles et vidéos sur la thèse :
- Sur la chaîne YouTube
- La chaîne Telegram des Vaillants Doctorants
- Rejoindre le groupe privé Facebook
- Le cercle des doctorants (Telegram)
- Canal Discord des doctorants
Et n’oublie pas, nous sommes de vaillants doctorants prêts à se donner les moyens de réussir notre thèse !


Donne moi ton avis en commentaires !